微信扫一扫
注意!用了近一个世纪的“退烧神药”,被禁用了!
国家药品监督管理局发布相关公告
停止安乃近注射液等品种
在我国的生产、销售和使用
注销药品注册证书
对安乃近片等品种修订说明书
△图源:国家药品监督管理局
安乃近是吡唑酮类解热镇痛药,在我国上市时间较早,制剂种类包括口服制剂、注射剂、滴鼻液等。
经国家药品监督管理部门组织评价,认为安乃近注射液、安乃近氯丙嗪注射液、小儿安乃近灌肠液、安乃近滴剂、安乃近滴鼻液、滴鼻用安乃近溶液片、小儿解热栓存在严重过敏反应、粒细胞缺乏症等严重不良反应,风险大于获益,且临床均有替代药品,根据《中华人民共和国药品管理法》第八十三条,予以注销药品注册证书。安乃近片等口服制剂尚有一定临床价值,对安乃近片、重感灵片、重感灵胶囊、复方青蒿安乃近片采取修订说明书的风险控制措施,增加安全警示信息,限制适用人群和适应症范围。
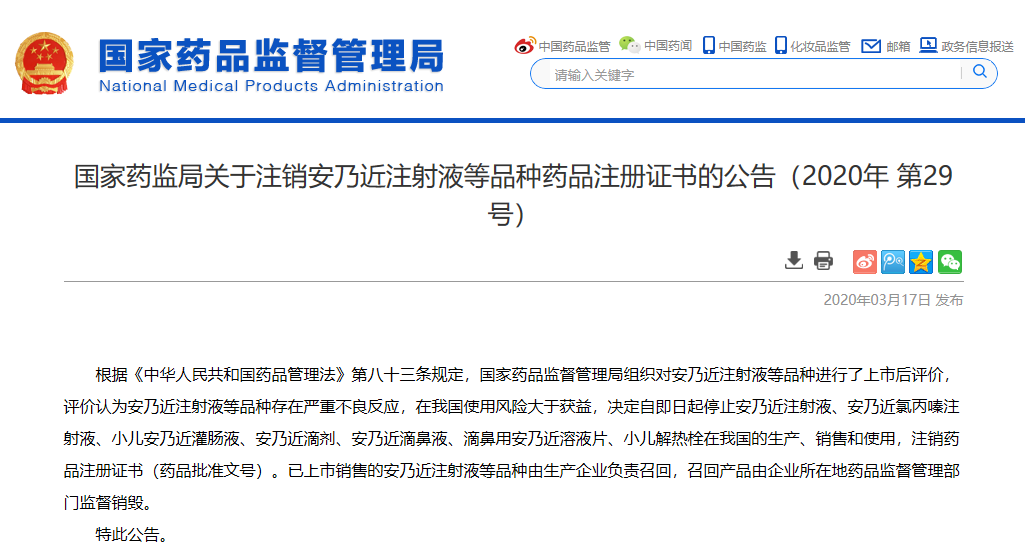
安乃近注射液等
品种药品注册证书的公告
(2020年 第29号)
根据《中华人民共和国药品管理法》第八十三条规定,国家药品监督管理局组织对安乃近注射液等品种进行了上市后评价,评价认为安乃近注射液等品种存在严重不良反应,在我国使用风险大于获益,决定自即日起停止安乃近注射液、安乃近氯丙嗪注射液、小儿安乃近灌肠液、安乃近滴剂、安乃近滴鼻液、滴鼻用安乃近溶液片、小儿解热栓在我国的生产、销售和使用,注销药品注册证书(药品批准文号)。已上市销售的安乃近注射液等品种由生产企业负责召回,召回产品由企业所在地药品监督管理部门监督销毁。
特此公告。
国家药监局
2020年3月10日
国家药监局关于修订
(2020年 第34号)
为进一步保障公众用药安全,国家药品监督管理局决定对安乃近片、重感灵片、重感灵胶囊、复方青蒿安乃近片说明书【不良反应】、【注意事项】等项进行修订。现将有关事项公告如下:
一、所有安乃近片、重感灵片、重感灵胶囊、复方青蒿安乃近片生产企业均应依据《药品注册管理办法》等有关规定,按照安乃近片、重感灵片、重感灵胶囊、复方青蒿安乃近片说明书修订要求(见附件),提出修订说明书的补充申请,于2020年6月12日前报省级药品监管部门备案。
修订内容涉及药品标签的,应当一并进行修订;说明书及标签其他内容应当与原批准内容一致。在补充申请备案后9个月内对所有已出厂的药品说明书及标签予以更换。
上述安乃近片、重感灵片、重感灵胶囊、复方青蒿安乃近片生产企业应当对新增不良反应发生机制开展深入研究,采取有效措施做好使用和安全性问题的宣传培训,涉及用药安全的内容变更要立即以适当方式通知药品经营和使用单位,指导医师、药师合理用药。
二、临床医师、药师应当仔细阅读安乃近片、重感灵片、重感灵胶囊、复方青蒿安乃近片说明书的修订内容,在选择用药时,应当根据新修订说明书进行充分的效益/风险分析。
三、患者应严格遵医嘱用药,用药前应当仔细阅读说明书。
特此公告。
国家药监局
2020年3月12日
已有30多个国家禁用此药
↓↓↓
资料显示,“安乃近”的主要成分是氨基比林和亚硫酸钠。1922年至1934年,氨基比林作为一种新型的解热镇痛药物流行于欧洲、美国,被人们用于退热、止痛。但是人们陆续发现服用此药的病人会产生多种副作用,如导致末梢血中白细胞减少,导致免疫力下降,并引发各种感染。1934年,仅美国就有1981人死于本病,欧洲死亡200余人。
在安乃近可能导致的众多副反应中,致死性粒细胞缺乏最为严重。国外的不良反应数据显示,1957~1966年国外报告粒细胞缺乏40例,1966~1975年瑞典药物不良反应委员会报告粒细胞缺乏38例,其中12例为致死性。粒细胞缺乏会使人体免疫力低下,成为感染性疾病的易感人群。
2008年,我国药品不良反应中心收集到的有关安乃近引起的不良反应数据中提到,安乃近类药物造成的死亡案例达到19例,不良反应包括过敏性休克,血液系统反应、皮肤及附属器官反应、泌尿系统反应、消化系统反应、呼吸心跳停止、大小便失禁等。
事实上,在欧美国家安乃近在40年多前就开始推出市场。1965年澳大利亚卫生部门禁止进口安乃近。1977年,美国食品药品监督管理局(FDA)正式禁用安乃近,并将该药品从美国市场上撤出,多种剂型的临床应用被停止。之后,全世界范围内陆续有30多个国家禁用此药。
来源:青岛西海岸新闻网
-
诚聘app试用员
面议 系统管理员/网管详情鹏力网络 -
招A2驾驶员10人 待遇优厚
8000元以上 司机详情青岛龙泽顺汽贸有限公司 -
电动车配件 诚聘 发货员 理货员 月工资5000以上
5000-8000元 其他详情工作餐顺风电动车配件城 -
电动车配件 诚聘送货司机 底薪加提成 5000-9000元
8000元以上 司机详情工作餐顺风电动车配件城 -
1w+诚聘CNC加工中心操作工
面议 CNC工程师详情五险青岛晟豪 -
诚聘销售代表经验不限 珠宝销售
5000-8000元 销售代表详情五险带薪年假带薪培训胶南家乐城潮宏基珠宝 -
诚聘胶南市 货架理货员
5000-8000元 其他岗位详情工作餐顺风电动车配件城 -
诚聘其他岗位经验不限
面议 其他岗位详情黄岛区怡彤良咔生活美容服务店 -
诚聘3D制图一名 女
3000-5000元 机械制图员详情五险公积金带薪年假青岛崎美塑料制品有限公司 -
诚聘业务拓展经理/主管经验不限
5000-8000元 业务拓展经理/主管详情五险公积金青岛金阳帝宝供应链有限公司 -
诚聘司机经验不限
面议 司机详情五莲县畅通物流有限公司 -
诚聘外贸经理/主管/专员/助理经验1年以上
面议 外贸经理/主管/专员/助理详情五险工作餐青岛冠料有限公司
-
下一条:黄海学院贵州籍女生深山搭篷上网课
 微信公众号
微信公众号